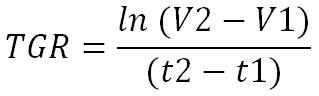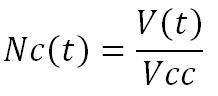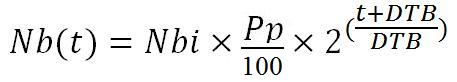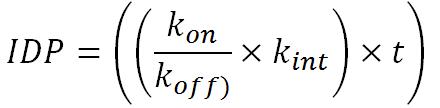Team:SupBiotech-Paris/Treatement modeling
From 2009.igem.org
Enguerrand (Talk | contribs) |
Enguerrand (Talk | contribs) |
||
| Line 1: | Line 1: | ||
{{Template:Supbiotechcss.css}} | {{Template:Supbiotechcss.css}} | ||
| - | {{Template: | + | {{Template:SupbiotechparisEn}} |
= Modelling of DVS efficiency on a lung tumour = | = Modelling of DVS efficiency on a lung tumour = | ||
Revision as of 22:19, 21 October 2009
Contents |
Modelling of DVS efficiency on a lung tumour
Context
Non-small cell lung carcinoma, or NSCLC, is an aggressive cancer, with a relatively high speed growth. Treatments are often ineficient, because the tumour growth is faster than the elimination by the drug
Objective
We have decided to model our treatment efficacy for this kind of tumour. Therefore we have modelled the tumour progression, our treatment evolution and efficacy.
The objective of the modelling is to verify if our treatment is able to eliminate the entire tumour.
Model segmentation
First, we had to recreate DVS complete mechanism and the tumour evolution. Then, for each step of the treatment, we have identified all the paramters that intervene, their actions and their interactions, in order to determine the model equations.
To simplifly the equation we have devided the mechanism and we have modelled each step separately.
Tumor and DVS evolution versus time
First step : Tumour development according to time
We consider the tumour is non métastatic and its growth is exponential.
Let the tumour have a volume V1 in cm3 at an instant t1.
Let the same tumour, at an instant t2, have a volume V2.
The tumour is considered in exponetial growth phase and without metastasis therefore its development equation, Tumor Growth Rate (TGR), is equal to :
Thus, thetumour volume according to the time (V(t)) is equal to :
Finally, knowing the Average volume of a cancerous cell (Vcc) (experimental data), if we regard the tumour as fraught (without cavity or blood vessel), we can determine that the Number of cancerous cells according to time (Nc(t)), without treatment effect, is equal to :
Second step : Development of the tissue vector
The tissue vector is injected to the patient at an instant t, near t2. The Number of injected vectors (Nbi) is 1x10^6. The pulmonary tropism of the vector isn’t perfect, only a Percentage (Pp) goes to the lung. The total number of tissue vector in the body increases, because this vector is bacterial and therefore possesses a Doubling period (DTB).
Thus we can establish that the tissue vector number in the lungs (Nb(t)) is equal to:
The number of Tissue vectors increases until injection of doxycycline. F rom then, tissue vectors lysis releases the cell vectors in the lung.
This injection time is not insignificant. Indeed, si if we wait long enough, tissue vectors number is sufficient to eliminate the tumour or at least to significantly reduce it. On the other hand, if we wait too long, a higher dose of doxycycline (and so potentially toxic) is necessary for cell vector release.
Thus we can use modelling to determine the optimal injection time of doxycyline (Tdox).
Third step : Release of the cell vector
Once the doxycycline injected, the vecteur cellulaire is released. Thevecteurs cellulaires number is proportional to the vecteurs tissulaires number in the lung. And yet, we know the average value of recombinant phage vectors released by M. avium (Npl) is equal to 100.
We can write vecteurs cellulaires number at the injection instant (Np(Tdox)) is equal to :
The vecteurs cellulaires number does not increase such as the vecteur tissulaire. Indeed, it decreases with time, because of the phage vector stability and of its cell penetration (to release the plasmide thérapeutique).
Its stability in the blood is equal to the phage vector deterioration constant (kdeg)'according to time. If we add this constant to the vecteurs cellulaires number equation according to time (Np(t)) we obtain the following formula :
The phage vector dispersion steps in the tumour and for cell penetration are the steps below Fourth and Fifth) because of their complexity.
DVS Efficiency
So, we determined:
- The size of the tumor versus time (initial volume + growth)
- The amount of tissue vector versus time
- The amount of released cellular vectors for a tissue vector
Now, we're going to determine the efficiency of our vectors for penetring cancer cells.
For that we are studying:
- The area of dispersal vector cell
- The importance of the cellular internalization of the vector in cancer cells.
Fourth step : The cell vector dispersion
In our model, we regard the blood as a newtonian fluid with a constant speed Vmax over time. We neglect the cardiac jolts and the turbulent flows related to the blood epithelium cavities.
Thevecteur cellulaire moves according to two axes. A X axe following the blood flow and an Y axe, orthogonal to the X axe.
The move in Y represents thephage vector diffusion in the blood. It depends on the equation of a particle (phage) diffusion in a fluid (blood).
With n, the number of particles, and D, the diffusion ratio.
The move in X only depends on de la blood flow propagation in the vessel. Indeed, we neglect the diffusion that also occures according to the X axe because it is 1000 times inferior to the particles propagation in the blood (linked to the importance of the blood flow). Phages move with different speeds distributed in a parabolic way from Vmax in the vessel center, to V0 at the vessel edge.
Closing to the vessel edge, the phages speeds decrease because of friction forces.
We can therefore determine how long it takes for a particle with a Vmax speed to atteint l'extrémité. On obtient ainsi le temps nécessaire à l’internalisation de tous les phages d’une bactérie.
Lorsque l'on associe le déplacement en Y (vitesse de diffusion) et le déplacement en X (vitesse du flux sanguin), on obtient, après intégration sur le périmètre d'un vaisseau sanguin, la surface d’action des vecteurs cellulaires issus d’un vecteur tissulaire. On est alors capable connaître le nombre de cellules cancéreuses détruites pour 100 vecteurs cellulaires ou 1 vecteur tissulaire
La vitesse de diffusion du vecteur cellulaire, REDUITE A D (ADPRES SIMPLIFICATION ???)est égale à 0,5µm.s-1 or la taille d’un capillaire sanguin est de 10µm de diamètre. La particule la plus éloignée met donc 10s à atteindre la paroi du vaisseau.(CE QUI EST NEGLIGEABLE ETANT DONNE L'ECHELLE DE TEMPS OBSERVEE AVANT LA SYNTHESE DE P53).
Grâce à cette durée de diffusion (10s) et à la vitesse du flux sanguin (1x10^3µm.s-1) dans les capillaires, on peut déterminer :
- La longueur (L) couverte par les vecteurs cellulaires libérés par un vecteur tissulaire.
- La surface (S) occupée par les phages dans un vaisseau sanguin de diamètre 2r.
L = 1 x 10^4 µm
2r = 10 µm
S = 2 π x L x r = 31,4x10^4µm²
Ainsi, un vecteur tissulaire peut potentiellement cibler plus de 31 000 cellules cancéreuses, or, il ne possède que 100 vecteurs cellulaires. On peut effectuer une simplification en disant que 100 vecteurs cellulaires détruisent 100 cellules cancéreuses et donc réduire l’équation de dispersion à une constante (NOM + VALEUR OU MOYEN DE DETERMINER LA VALEUR ??).
Pour le phage, une fois la paroi atteinte, entre en jeu l’internalisation cellulaire. Ce modèle répond à deux schéma d’action.
Cinquième étape : L’internalisation du vecteur cellulaire
Une fois au contact de la cellule, le vecteur cellulaire a deux schémas d’action possibles.
- Le vecteur se fixe puis il se détache de la cellule.
- Le vecteur se fixe puis il se fait internaliser au sein de la cellule.
On peut modéliser cela en fonction du temps et des Constantes d’Association (kon) , de Dissociation (koff) et d’Internalisation (kint) .
Les étapes les plus courtes, en échelle de temps, sont certainement les étapes concernant le phage. L’internalisation est la plus courte d’entre elle, après avoir déterminé les constantes, on sait que plus de 320 vecteurs cellulaires sont internalisés par seconde au contact d’une paroi.
En raison des échelle de temps, en heure, on peut réduire cette équation en fonction du temps à une simple constante.(UNE CONSTANTE NE DEPEND PAS DU TEMPS donc : kon, koff et kint forment une seule constante égale à 320 ? Ou c'est IDP qui devient une constante ?)
Une fois internalisé, le plasmide thérapeutique engendre l’apoptose de la cellule en 1h, diminuant le nombre de cellule cancéreuse, Nc(t), et le volume tumoral, Vc.
Evolution en simultanée du DVS et d'une tumeur
L’équation d'évolution de notre modèle en fonction du temps est égale à :
Avec :
- Nc(t), le nombre de cellules cancéreuses dans le temps,
- V(t), le volume tumoral,
- V1 et V2, deux volumes tumoraux à respectivement des temps t1 et t2,
- Vcc, le volume d’une cellule cancéreuse,
- Nbi, le nombre de vecteurs tissulaires injectés,
- Pp, le pourcentage pulmonaire de vecteurs tissulaires par rapport à la dose injectée,
- DTB, le temps de doublement du vecteur tissulaire,
- tinj, le temps d'injection du vecteur tissulaire,
- Npl, le nombre de vecteurs cellulaires libérés par bactérie.
On peut négliger (aux vues des différences entre les échelles de temps ou d’espace) certains facteurs :
- Kdeg, la constante de dégradation du phage, car tous les phages sont internalisés en 10s.
- D, la diffusion du phage et IDP, l’internalisation cellulaire, car on considère que 100 phages rentrent dans 100 cellules différentes (pour une valeur potentielle de 31400) donc tout cela est égal à 1.
Simulation de traitement
 "
"